L’observation des systèmes biologiques par microscopie de fluorescence connait une véritable révolution avec l’avènement des techniques de super-résolution. Les progrès conjugués en optique et photomanipulation des sondes fluorescences, permettant de dépasser la limite de diffraction, ont été récompensés en 2014 par le Prix Nobel de Chimie. Le microscope se mue ainsi en nanoscope offrant des échelles d’observation jusque-là inégalées. Cependant le gain en résolution n’est pour l’instant pas équivalent dans les trois dimensions, et l’amélioration suivant l’axe de propagation du faisceau optique reste un défi. La communauté se mobilise afin d’offrir différentes stratégies permettant d’atteindre une résolution 3D isotrope des molécules fluorescentes.
Nos équipes proposent une approche originale basée sur les propriétés d’émission des fluorophores à proximité de la lamelle de verre supportant les cellules. Cette émission dite « supercritique » a longtemps était appelée lumière interdite car non décrite par les lois de l’optique classique. Cette composante d’émission émise aux grands angles peut être facilement détectée grâce à l’apparition récente d’objectifs à très grande ouverture numérique (1.49). Si le fluorophore est situé directement sur la lamelle, la moitié des photons que nous détectons sont émis dans le régime supercritique. En fonction de l’élévation du fluorophore par rapport à la lamelle, la quantité de photons émise dans ce régime diminue ensuite de façon exponentielle, offrant accès à une localisation axiale absolue à l’échelle nanométrique (précision 15 nm). Grâce au caractère absolu, propriété unique à notre approche, la comparaison ou l’association de différentes mesures (inter ou intra échantillons) est instantanée. Le multiplexage des informations de localisation permet par exemple de reconstruire des architectures moléculaires 3D complexes impliquant des dizaines de protéines.
Cette méthode permet d’observer des échantillons biologiques avec une résolution 3D isotrope à proximité de la lamelle, ceci présente un intérêt majeur pour le suivi des évènements membranaires, les problématiques de motilités cellulaires et d’adhésion. La technique est très simple à mettre en œuvre car elle nécessite uniquement l’insertion d’un module entre le microscope et la caméra. Elle est protégée par le brevet et un projet de startup est porté par le doctorant ayant mené les travaux.
Ces travaux ont reçu le soutien de l’Agence Nationale de la Recherche (projet SMARTVIEW), du fond AXA pour la science, du Labex WIFI et du DIM NanoK (projet NanoSAF).
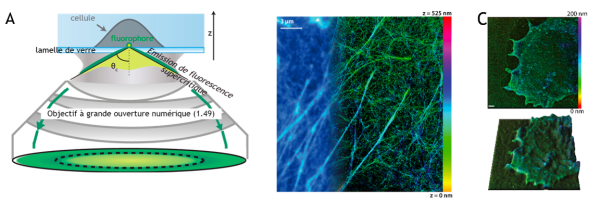
A) Principe de l’émission de fluorescence supercritique B) Image 3D du réseau d’actine d’une cellule : super-résolue à droite/image classique à gauche C) Grâce à l’image super-résolue (en haut, échelle 1µm), une image de la nanotopologie de la membrane cellulaire peut être reconstruite en 3D.
Contacts :
Sandrine Lévêque-Fort sandrine.leveque-fort@u-psud.fr, Institut des Sciences Moléculaires d’Orsay
Emmanuel Fort emmanuel.fort@espci.fr, Institut Langevin
Référence : N. Bourg, C. Mayet, G. Dupuis, T. Barroca, P. Bon, S. Lécart, E. Fort, S. Lévêque-Fort « Direct optical nanoscopy with axially localized detection », accepté pour publication dans Nature Photonics
Pour en savoir plus :
http://www.nature.com/nphoton/journal/vaop/ncurrent/full/nphoton.2015.132.html
https://youtu.be/Wf8iHYww9lY








